COVID-19由SARS-CoV-2引起,是一种严重疾病,导致全球广泛发病和死亡。我们对 SARS-CoV-2 和 COVID-19 的认识在 2020 年迅速发展。截至 2020 年 12 月,美国已有超过 30 万人死亡,冬季病例增长异常迅速。
尽管疾病的严重程度与免疫失调相关,但人们对 COVID-19 炎症的细胞机制和发病机制仍知之甚少。
近日,来自康奈尔大学的研究团队使用小鼠适应的 SARS-CoV-2 菌株 MA10 来研究适应性免疫细胞在疾病中的作用。研究结果表明,虽然适应性免疫细胞对于清除 SARS-CoV-2 感染很重要,但这是以炎症和病理增加为代价的。该研究题为“Adaptive immune cells are necessary for SARS-CoV-2–induced pathology”,发表在Science Advence杂志。

SARS-CoV-2 通过人类血管紧张素转换酶 2 (hACE-2) 受体进入宿主细胞,这限制了已建立的动物模型用于研究影响疾病的免疫因素的用途。在研究病毒感染过程所需的主要小鼠模型依赖于hACE-2 受体的过度表达或转导。虽然 hACE-2 过表达和转导模型很有价值,但在解释宿主反应时需要注意一些问题。
为了解决这个问题,研究人员开发了小鼠适应病毒 SARS-CoV-2 MA10,该小鼠模型的一个主要优点是受体在预期组织中以内源水平表达,类似于观察到的 hACE-2 表达模式,此外,它允许使用完善的基因小鼠模型来研究特定免疫细胞在病毒感染过程中的作用。
研究人员首先通过鼻内感染 SARS-CoV-2 MA10 的rag1−/− 小鼠,每天监测体重,直到感染后 3、7 或 14 天(dpi) 对动物实施安乐死。作者观察到,受感染的 3 个月大的对照组小鼠在体重减轻峰值时体重减轻了约3%,但出乎意料的是,在rag −/−小鼠中没有观察到这种情况。
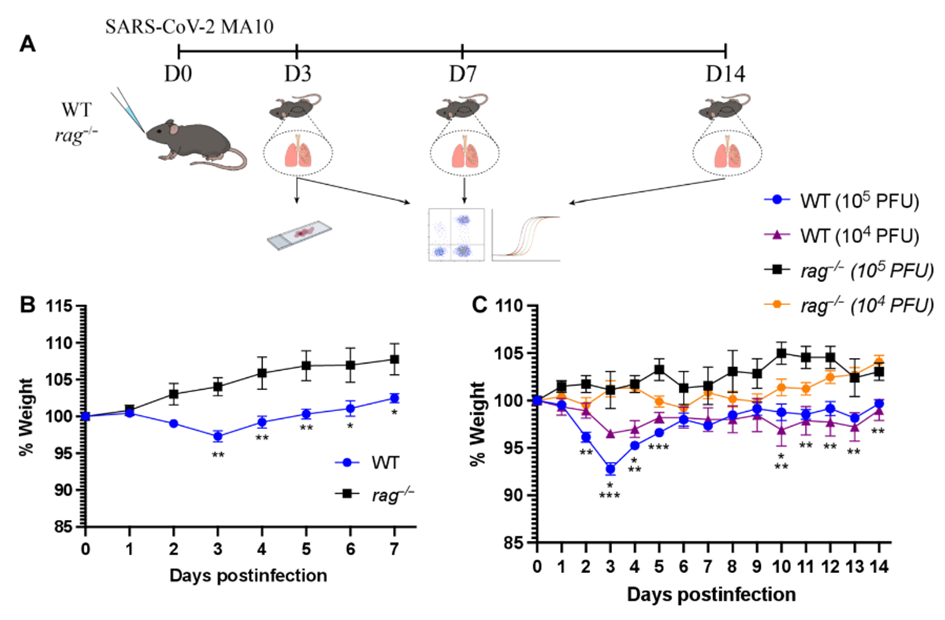
进一步研究发现,与感染SARS-CoV-2 MA10的野生型动物相比,rag−/-小鼠在感染早期的病毒复制较少,并且在30 dpi内不能清除病毒,它们不会发展出疾病和病理的严重程度。
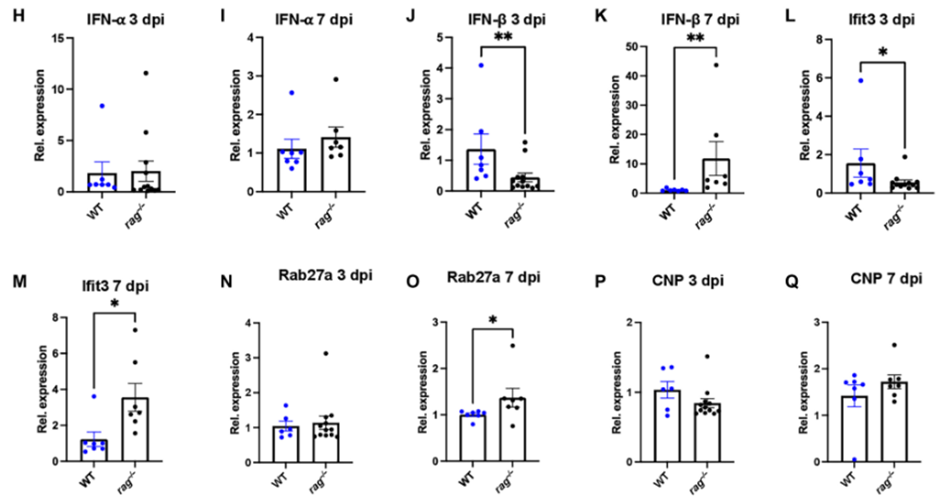
免疫学分析表明,与rag−/−小鼠相比,在感染后体重减轻高峰期间,对照组小鼠的肺中性粒细胞和促炎细胞因子有所升高。此外,rag −/−小鼠在感染早期表现出炎症抑制的特征。
由于淋巴细胞在对照组小鼠的 SARS-CoV-2 MA10 病理学中起主要作用,研究人员希望分离出关键细胞参与者的潜在贡献。辅助T1细胞和细胞毒性 CD8+T 细胞是重要的 αβT 细胞亚群,参与对病毒感染的反应,表达高水平的抗病毒效应子。
作者用SARS-CoV-2 MA10 感染 6 个月大的缺乏αβT细胞的tcrα−/−小鼠,随后监测体重减轻并收集肺部以分析4 和 14 dpi 时的病理学和病毒载量。结果表明αβT 细胞至少部分负责这种感染的免疫发病机制,但它们并不单独起作用,也不完全负责rag−/−小鼠之间的全部表型差异。
SARS-CoV-2 感染后先天性和适应性免疫系统的失调会导致免疫病理学。为了研究将循环淋巴细胞引入rag−/−小鼠中是否可以重现对照组小鼠感染后观察到的体重减轻,作者收集了 6 个月大的对照组小鼠的脾细胞并在感染前7天注射 5 × 10 7个细胞,结果发现在 3 dpi 时,对照组小鼠在感染后比rag−/−小鼠损失的体重明显更多。
值得注意的是,只有WT小鼠细支气管中的上皮细胞脱落或坏死,而rag -/-小鼠则没有。
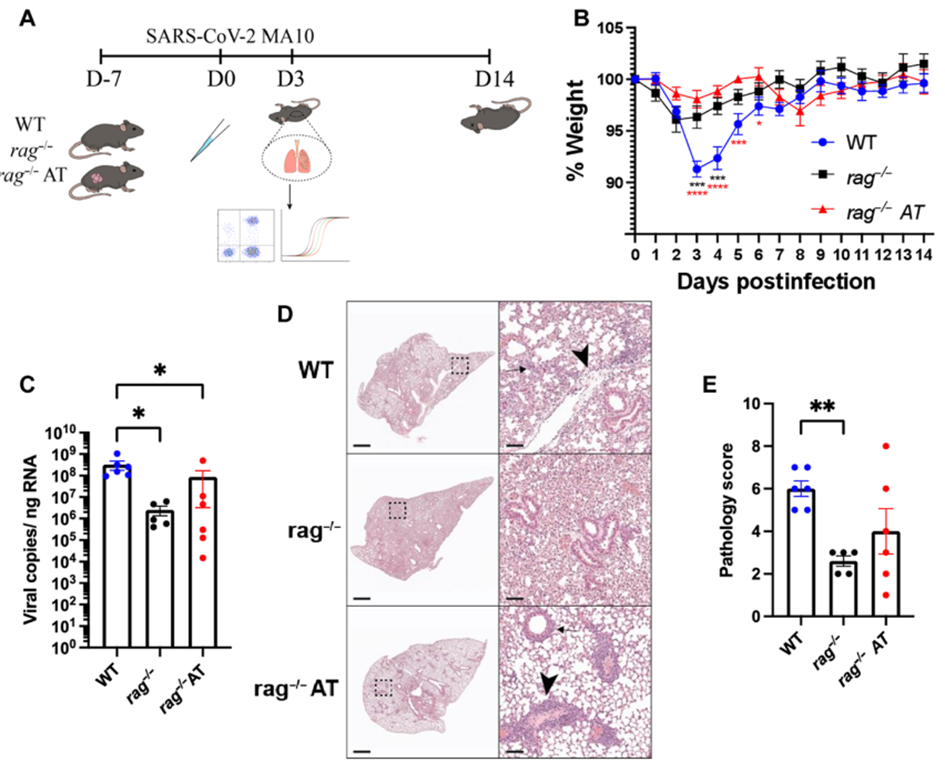
总体而言,该研究已经证明,在感染 SARS-CoV-2 MA10 后,缺乏适应性免疫系统的动物比具有强大适应性免疫系统的动物的发病率更低。
将免疫细胞瞬时转移到免疫功能低下的动物中不足以诱导在对照组动物中观察到的病理学,这暗示了肺部驻留免疫细胞(包括 T 细胞)在驱动疾病中的作用。此外,与对照组小鼠相比, rag-/−小鼠表现出减弱的促炎特征,同时仍限制病毒复制。
作者提出了一个模型,为理解适应性免疫在驱动 COVID-19 病理学中的作用提出了新问题,未来的研究将寻求揭示适应性免疫细胞驱动 COVID-19 疾病的机制和途径。这些发现反过来可能对其他冠状病毒引起的传染病产生重要影响。
来源:https://www.science.org/doi/10.1126/sciadv.adg5461













